Água Como Substância
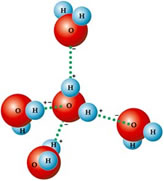
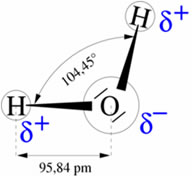
A molécula da água é formada por dois átomos de hidrogênio ligados a um átomo de oxigênio por meio de ligações covalentes (figura 1). O ângulo de ligação é de 104,45º em função da estrutura tetraédrica dos orbitais sp3 do oxigênio (figura 2).
A água possui, portanto, uma dipolaridade bastante forte com as cargas positivas do hidrogênio e negativas do oxigênio, resultando em uma forte rede de ligações intermoleculares. Essas ligações são denominadas "pontes de hidrogênio" e são interagidas pela "força de Van der Waals".
As propriedades da água são determinadas pelo ângulo de ligação. Se a água apresentasse um ângulo de 180º entre as ligações, talvez ela não fosse um líquido à temperatura ambiente.
PROPRIEDADES DA ÁGUA - ESTADO FÍSICO
Sólido
A água apresenta menor densidade no estado sólido do que no estado líquido, o que explica por que o gelo boia sobre a água líquida.
| Temperatura (°C) | Densidade (g/cm³) |
| 100 | 0,9584 |
| 80 | 0,9718 |
| 60 | 0,9832 |
| 40 | 0,9922 |
| 30 | 0,9956502 |
| 25 | 0,9970479 |
| 22 | 0,9977735 |
| 20 | 0,9982071 |
| 15 | 0,9991026 |
| 10 | 0,9997026 |
| 4 | 0,9999720 |
| 0 | 0,9998395 |
| −10 | 0,998117 |
| −20 | 0,993547 |
| −30 | 0,983854 |
Densidade da água em gramas por centímetro cúbico em várias temperaturas em graus Celsius. | |
Geralmente, a água se expande ao congelar devido à sua estrutura molecular aliada à elasticidade incomum das ligações de hidrogênio e à conformação cristalina particular de baixa energia que ela assume em condições normais de pressão. Isto é, ao resfriar-se a água tenta organizar-se numa configuração de rede cristalina que alonga as componentes rotacionais e vibracionais das ligações, de forma que cada molécula de água é afastada das vizinhas. Isso efetivamente reduz a densidade p da água quando se forma gelo sob condições normais de pressão.
Líquido
A água é primariamente um líquido em condições ambientes, o que não se poderia prever, uma vez que os outros hidretos análogos da família do oxigênio da tabela periódica são gases como o sulfeto de hidrogênio, por exemplo. A razão pela qual o hidreto de oxigênio (água) forma um líquido está baseada no fato de ele ser mais eletronegativo que todos esses elementos (exceto pelo flúor).
O oxigênio atrai elétrons muito mais fortemente que o hidrogênio, levando a uma carga resultante positiva nos átomos de hidrogênio e a uma carga resultante negativa no átomo de oxigênio. A presença de carga nesses átomos dá à água um "momento dipolo". A atração elétrica devida a esse dipolo aproxima as moléculas de água, tornando mais difícil separá-las e, por consequência, elevando o ponto de ebulição.
A água pode ser vista como um líquido polar que se dissocia minimamente num íon hidrônio (H3O+ aq) e num íon hidroxila (OH- aq) associado. A água está em equilíbrio dinâmico entre os estados líquido, sólido e gasoso nas condições ambientes de temperatura e pressão e é a única substância pura encontrada naturalmente na Terra com essa característica.
Gasoso
As pontes de hidrogênio também são responsáveis por esta característica. Para evaporar a água, primeiro deve-se romper as pontes de hidrogênio e, posteriormente, dotar as moléculas de água de suficiente energia cinética para se passar para a fase gasosa. Para evaporar 1 grama de água precisa-se de 540 calorias a uma temperatura de 20ºC.
Como o gás, o vapor d'água é completamente miscível com o ar. Por outro lado, a pressão máxima de vapor termodinamicamente estável com a líquida (ou sólida) numa dada temperatura é relativamente baixa se comparada com a pressão atmosférica total. Por exemplo, se a pressão parcial de vapor for 2% da pressão atmosférica e o ar for resfriado a partir de 25ºC, aos cerca de 22ºC a água começa a condensar-se, definindo o ponto de orvalho, formando neblina ou orvalho.
O processo inverso faz com que a neblina "desapareça" pela manhã. Se a umidade aumenta à temperatura ambiente (por exemplo, devido a um chuveiro quente) e a temperatura se mantém a mesma, a água gasosa logo chega à pressão de mudança de fase e se condensa como vapor. Um gás nesse contexto é dito saturado ou a 100% de umidade relativa quando a pressão e o vapor d'água no ar estão em equilíbrio com a pressão de vapor devido à água (líquida).
Autores
Lauro de Oliveira Silva Júnior
Lúcio Carramillo Caetano
Fontes
Wikipedia, acessado em 07/01/2010.
Macedo Barros Águas & Águas, 2004.





